Introduction
Le photon est la particule élémentaire vecteur de la lumière. Il existe une relation directe entre l’énergie d’un photon et sa couleur (ou, sa longueur d’onde diront les physiciens). Un photon bleu transporte plus d’énergie qu’un photon rouge. Plus un photon est énergétique, plus sa longueur d’onde (représentée par la lettre grecque λ (lambda) est faible (ou courte).
Energie et couleur
La relation entre énergie et longueur d’onde est : E = h·c/λ
avec
- h = constante de Planck (6,62×10-34 J·s)
- c = vitesse de la lumière dans le vide (299792458 m/s).
- λ = longueur d’onde
Un spectre est une représentation du niveau d’émission d’un objet en fonction de sa longueur d’onde. La gamme de longueur d’ondes des photons dans le visible va de 400 nm (nanomètres) à 700 nm. Les gammes de longueur d’onde des différents types de rayonnement électromagnétique (= de « lumières ») classés par énergie croissante sont :
- Ondes radio : λ > 10 m
- Ondes radar : 10 m > λ > 1 m
- Micro-ondes : 1 m > λ > 1 mm
- Infrarouges (IR) : 1 mm > λ > 700 nm
- Visible : 700 nm > λ > 400 nm
- Ultraviolets (UV) : 400 nm > λ > 10 nm
- Rayons X : 10 nm > λ > 0,01 nm
- Rayons γ (Gamma) : λ < 0,01 nm
Couleur de chaleur
Les deux principaux processus d’émission en astronomie sont :
- L’émission de type corps noir (émission thermique)
- La fluorescence
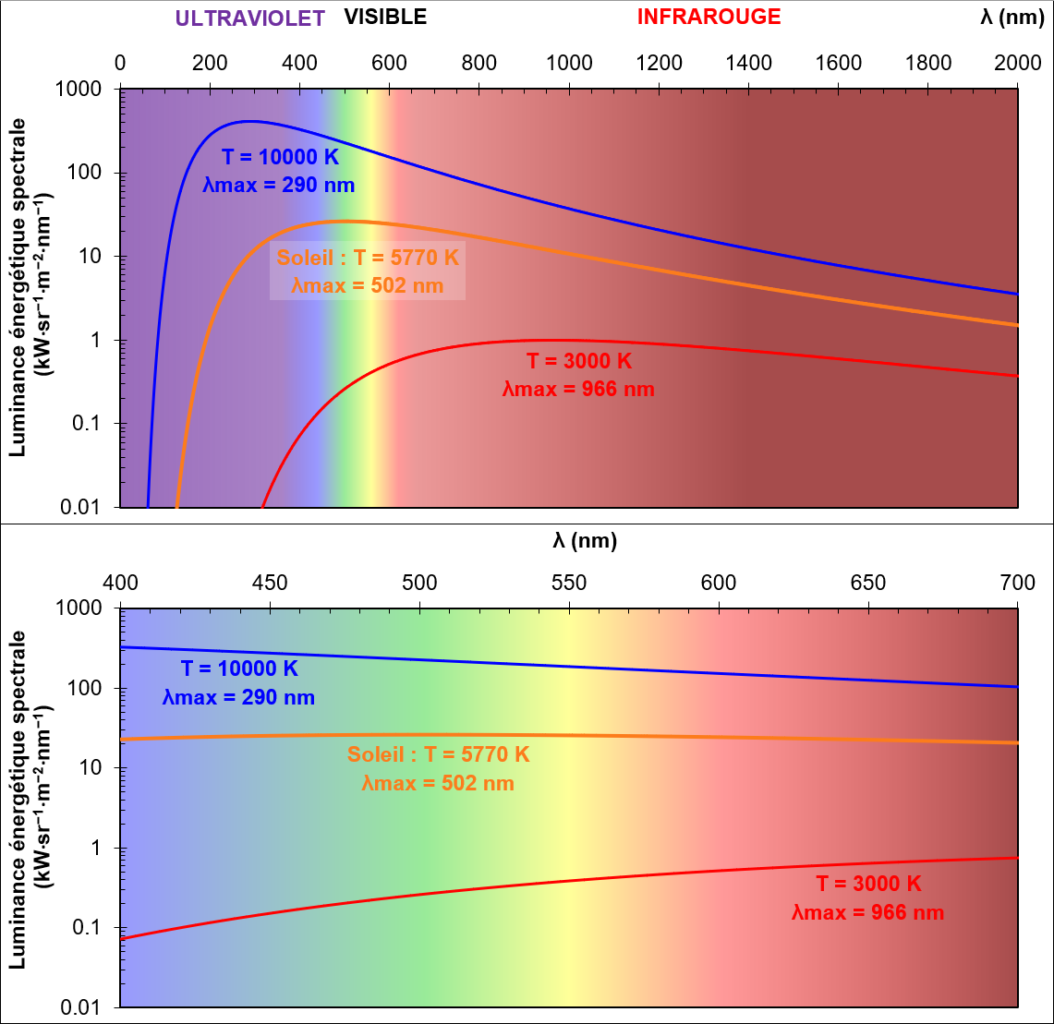
L’émission d’un corps noir est une émission thermique : tout corps porté à une certaine température émet un continuum de lumière ce qui signifie que cette émission émet des photons sur un large domaine de longueur d’onde (ou domaine spectral).
Ainsi, un objet chauffé à 20-25°C émettra dans l’infrarouge, autour de 10 µm (=10000 nm). C’est pour ça que l’on utilise des caméras infrarouges quand on veut voir des humains la nuit.
Si un prend, au hasard, un corps porté à environ 5500°C (ou 5773 K, le Kelvin est l’unité de mesure de la température préférée des physiciens : c’est comme les degrés Celsius auxquels on ajoute 273,15), le spectre présentera un maximum d’émission vers 500 nm, en plein milieu du domaine visible. 5600-5800 K, c’est justement la température de surface du soleil qui, grossièrement, émet comme un corps noir. Une étoile plus chaude émettra majoritairement dans les UV, une étoile plus froide dans les IR.
Couleur de fluorescence
Le processus d’émission de lumière par fluorescence est de nature totalement différente puisqu’il est dû à l’émission d’un photon par un électron qui passe d’un niveau énergétique d’un atome ou une molécule à un niveau d’énergie inférieur.
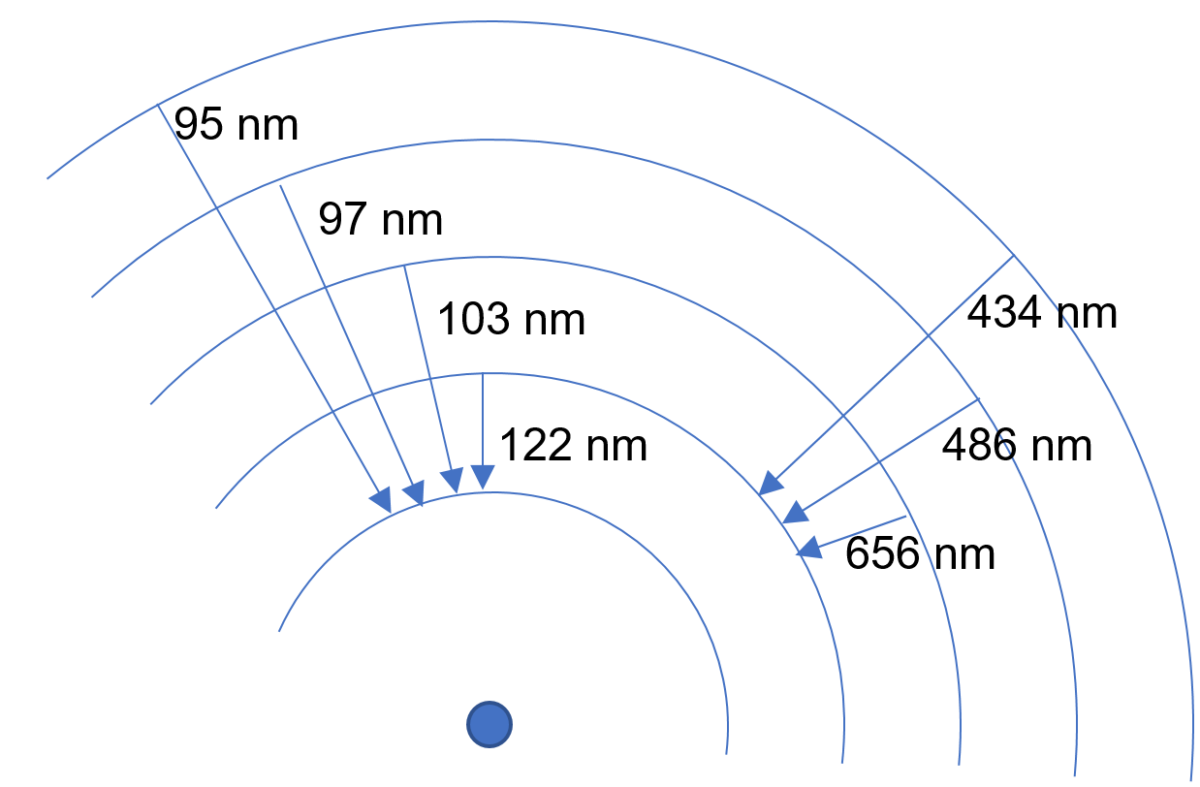
Un atome est formé d’un noyau, chargé positivement, autour duquel « orbitent des électrons », chargés négativement. Mais contrairement à un satellite dont on peut stabiliser l’orbite à n’importe quelle altitude (s’il n’y a pas une atmosphère pour le freiner et le faire tomber), les « altitudes » (en fait, les niveaux d’énergie) auxquelles les électrons sont « autorisés » à se déplacer sont quantifiées : c’est niveau 1 ou niveau 2 ou niveau 3…etc mais pas 1,26 ou 2,73. Le niveau 1, le plus bas en énergie, est appelé niveau fondamental, les niveaux supérieurs sont appelés niveaux excités.
Et si un électron « tombe » d’un niveau à un niveau inférieur en énergie, il émet un photon dont l’énergie est strictement égale à la différence d’énergie des deux niveaux entre lesquels s’effectue la transition.
Pour l’atome le plus simple, l’hydrogène (1 seul électron orbitant autour d’un noyau formé d’un seul proton), le niveau fondamental (n = 1) est à -13,6 eV (électron-Volt, c’est l’unité d’énergie favorite des atomistes ; 1 eV = 1,6×10-19 J)).
L’énergie des autres niveaux est donnée par la relation E = -13,6/n², n’étant le numéro du niveau.
E1 = -13,6 eV
E2 = -13,6/4 eV = -3,39 eV
E3 = -13,6/9 eV = -1,51 eV
…
En utilisant la relation E = h·c/λ, si on convertit les eV en Joules, pour la transition d’un électron du niveau 3 au niveau 2, on obtient :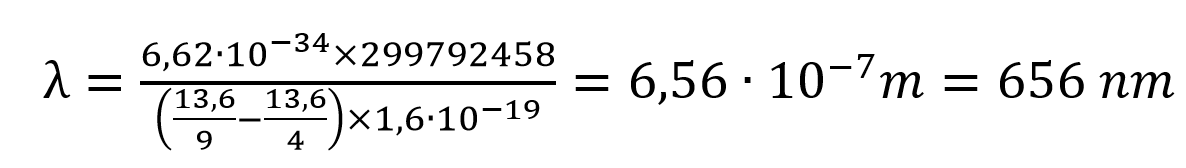
: c’est la longueur d’onde de la raie Hα !
On peut noter qu’un électron peut aussi descendre d’un niveau excité vers le fondamental en plusieurs étapes, et donc en émettant plusieurs photons de plus basse énergie.
Ainsi, l’intensité d’une raie dépend-elle de l’efficacité du processus d’excitation (par exemple, certains atomes ou molécules sont plus facile à excité que d’autres), et des chemins de désexcitation les plus probables. C’est pourquoi, les raies les plus intenses ne sont pas nécessairement dues aux espèces les plus abondantes.
Septembre 2021 @Axel Randonnier